研究概要
私たちの研究室では「かたち」の詳細な観察から、その「はたらき」を知ることを基本姿勢としています。この形態学的手法は、歴史的には肉眼で見える形態の観察、マクロ形態学 (Morphology) や
解剖学 (Anatomy) から始まりました。時代とともに大きく進歩し、現在ではナノメートルレベルの分子の「かたち」やさらに小さい原子までも観察することが可能な分子形態学 (Molecular Morphology) となりました。私たちは分子形態学研究で必須の技術である、クライオ電子顕微鏡法とX線結晶構造解析法を駆使し、様々な分子の「かたち」を観察してその「はたらき」に迫ります。生物・人体の生理的なメカニズムを解明したり、難病の発症機構を明らかにすることで治療法の開発にも繋げたいと考えています。
主な研究課題
1) 微小管ダイナミクス制御の生理・病理機構の解明
(学術変革領域(A)クロススケール新生物学)
細胞は、器官・組織に特異的な機能を発現するため、その機能に適した形態へと「かたち」を変えます。それを先導するのが微小管をはじめとした細胞骨格であり、その異常は神経変性疾患や心不全などの病態を発症します。本課題では、細胞によって異なる様相を呈する微小管ネットワークがどのように形成されるのか、その根本のメカニズムを解明するとともに、その破綻による疾病発症のメカニズムにも迫ります。
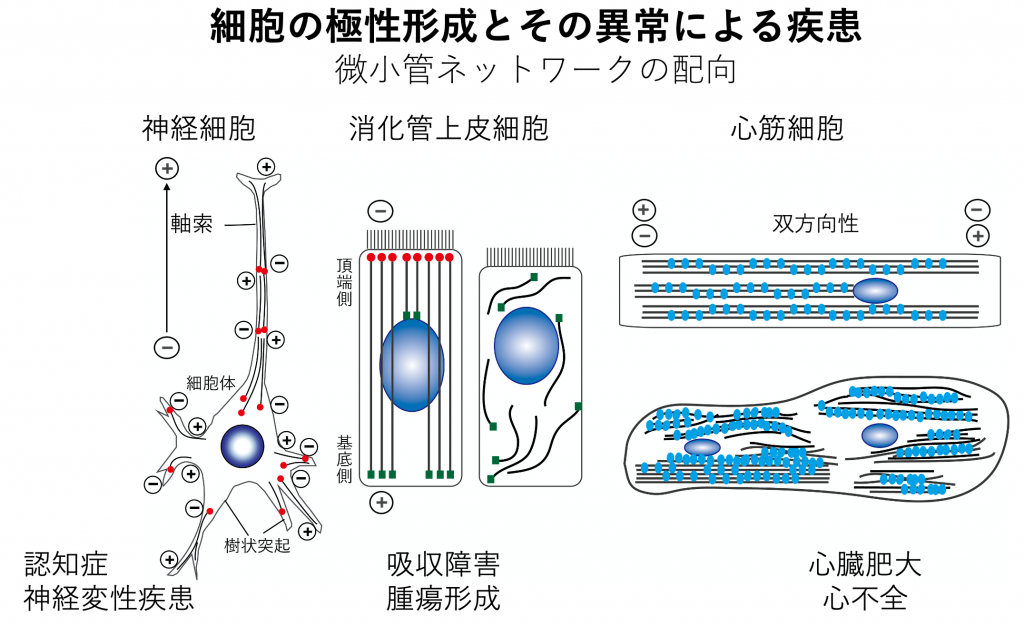
- 非中心体性微小管ネットワーク形成の分子機構
神経細胞、上皮細胞、(心)筋細胞など、中心体に依存しない微小管ネットワーク形成機構を解明します。
– CAMSAPs (Imasaki et al., bioRxiv 2021)
– MAP4 (Shigematsu et al., JCB 2018)
– 神経細胞軸索における微小管ネットワーク形成・制御の分子機構
* Kinesin-1 (Shima et al., JCB 2018; Yajima et al., JCB 2012)
* CRMP2 (Niwa et al., Sci. Rep 2017; Sumi et al., Cell Struct. Funct. 2018)
* MTCL proteins
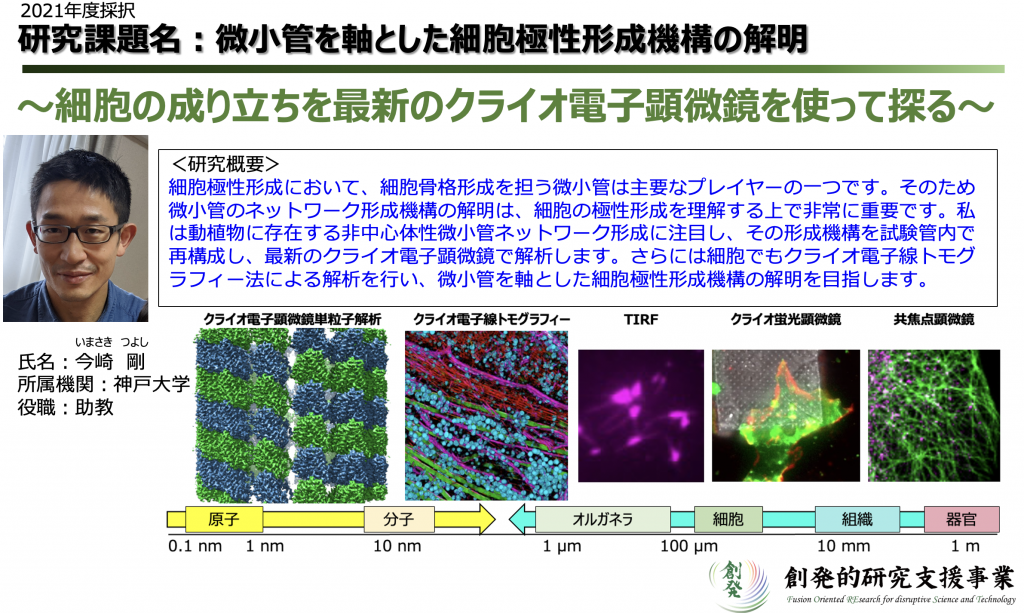
- 微小管を軸とした細胞極性形成機構の解明
(JST創発的研究支援事業 )
細胞の極性形成機構を、動植物細胞における非中心体性微小管形成メカニズムを研究することにより解明します。
- 微小管モーターキネシンの動作機構と微小管ダイナミクス制御
細胞内の物質輸送を司る微小管モーターキネシンは、微小管の安定性の制御にも関わっている。本研究では、キネシンの運動機構解明に加え、キネシンがどのように微小管の安定性を制御するのか、その分子機構を解明します。
順行性モーター
– Kinesin-1 (Shima et al., JCB 2018; Morikawa et al., EMBO J. 2015)
– Kinesin-3 (Hirokawa et al., Nat. Rev. Mol. Cell Biol. 2009; Nitta et al., NSMB 2008; Nitta et al., Science 2004)
– Kinesin-4 (Chang et al., JMB 2013; Taguchi et al., bioRxiv 2022):順行性に駆動し、さらに微小管ダイナミクスを阻害する二刀流モーター。
– Kinesin-8 (Wang et al,, eLife 2016):順行性に駆動し、さらに微小管ダイナミクスを脱重合する二刀流モーター。
微小管脱重合モーター
– Kinesin-13 (Ogawa et al., Cell 2004)
逆行性モーター
– Kinesin-14 (Yamagishi et al., Structure 2016) - 微小管モーターキネシンの動作機構と微小管ダイナミクス制御
細胞内の物質輸送を司る微小管モーターキネシンは、微小管の安定性の制御にも関わっている。本研究では、キネシンの運動機構解明に加え、キネシンがどのように微小管の安定性を制御するのか、その分子機構を解明します。
順行性モーター
– Kinesin-1 (Shima et al., JCB 2018; Morikawa et al., EMBO J. 2015)
– Kinesin-3 (Hirokawa et al., Nat. Rev. Mol. Cell Biol. 2009; Nitta et al., NSMB 2008; Nitta et al., Science 2004)
– Kinesin-4 (Chang et al., JMB 2013; Taguchi et al., bioRxiv 2022):順行性に駆動し、さらに微小管ダイナミクスを阻害する二刀流モーター。
– Kinesin-8 (Wang et al., eLife 2016):順行性に駆動し、さらに微小管ダイナミクスを脱重合する二刀流モーター。
微小管脱重合モーター
– Kinesin-13 (Ogawa et al., Cell 2004)
逆行性モーター
– Kinesin-14 (Yamagishi et al., Structure 2016)
2) 転写制御を切り口とした生理・病理機構解明
- 個体の恒常性を司る幹細胞制御システムの解明:造血幹細胞の維持機構からその破綻による白血病発症、老化メカニズムの解明
- 新規白血病治療法開発に向けた転写メディエーター複合体CDKモジュールの転写制御機構の解析
3) 心筋メカノバイオロジー機構の構造基盤の解明
(AMED-CREST メカノバイオロジー)
心臓は自律拍動する器官であり、また常に血圧=メカニカルストレスにさらされている。拡張型心筋症などの心疾患では、メカニカルストレス応答機構の異常がその増悪に関与する。本研究では、メカニカルストレスにより正常・異常心筋細胞内で起こる分子構造変化を、クライオ電子顕微鏡技術により分子レベルで明らかにし、疾患の発症原理を解明するとともに、新規治療法創出に貢献する。
- 拡張型心筋症のクロススケール構造解析による分子病理機構の解明 (Yamada et al., submitted, 2022)
- 心筋一細胞ストレッチ技術と電子顕微鏡技術との融合
4) 神経変性疾患モデル細胞を用いた
クライオ電子顕微鏡分子構造解析
(JSTムーンショット目標2)
認知症の原因の三大疾患であるアルツハイマー型認知症、パーキンソン病、血管型認知症の分子・細胞レベルの構造異常を解明し、新たな治療薬早出へとつなげます。 リンク
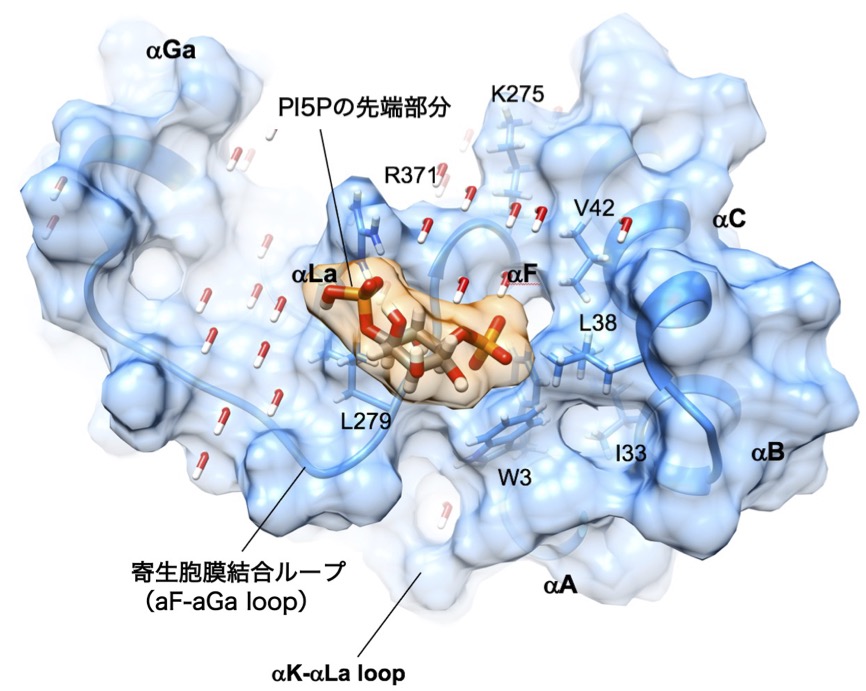
5) 原子レベルで解明するトキソプラズマ寄生胞膜破壊と
病原性因子によるその破綻
(AMED 新興・再興感染症)
人体には、トキソプラズマなどの寄生虫感染時に働く生体防御機構が存在します。その中心的な役割を担うタンパク質群が、インターフェロン誘導性GTPaseである。これらのタンパク質群が、どのように寄生胞膜(寄生虫を内部に匿う膜構造)を破壊するのか、その分子機構を原子レベルの構造解析により解明します。
- IRGs(IFN-γ–inducible immunity-related GTPase)の構造・機能解析 (Saijo et al., Life Sci. Alli. 2022)
6) 革新的化合物探索・合成手法による
新規抗菌アジュバントの創出
(AMED-CREST 感染症創薬に向けた研究基盤の構築と新規モダリティ等の技術基盤の創出)
- 本研究グループが発見した低分子化合物とターゲット蛋白質の相互作用を、X線結晶構造解析、クライオ電子顕微鏡解析により構造解析
- 創薬を目指しております
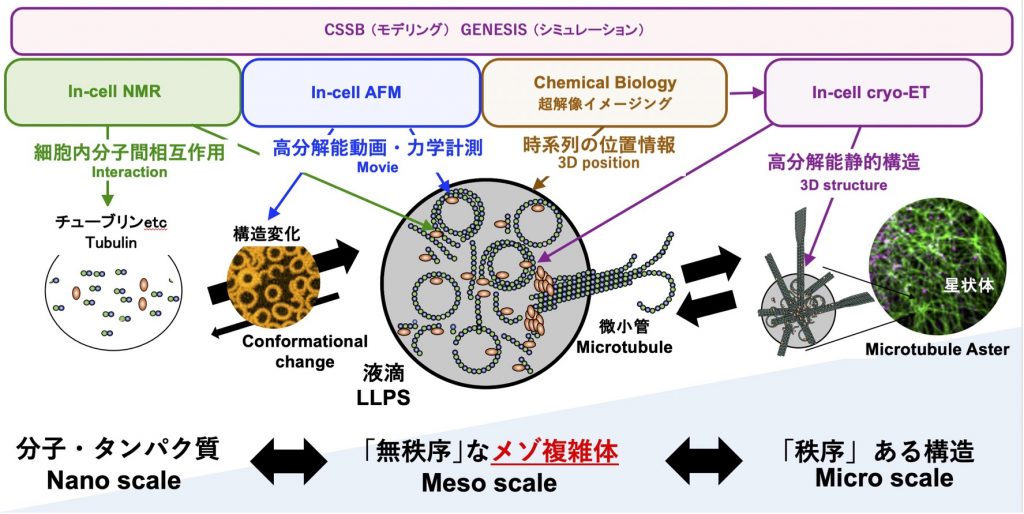
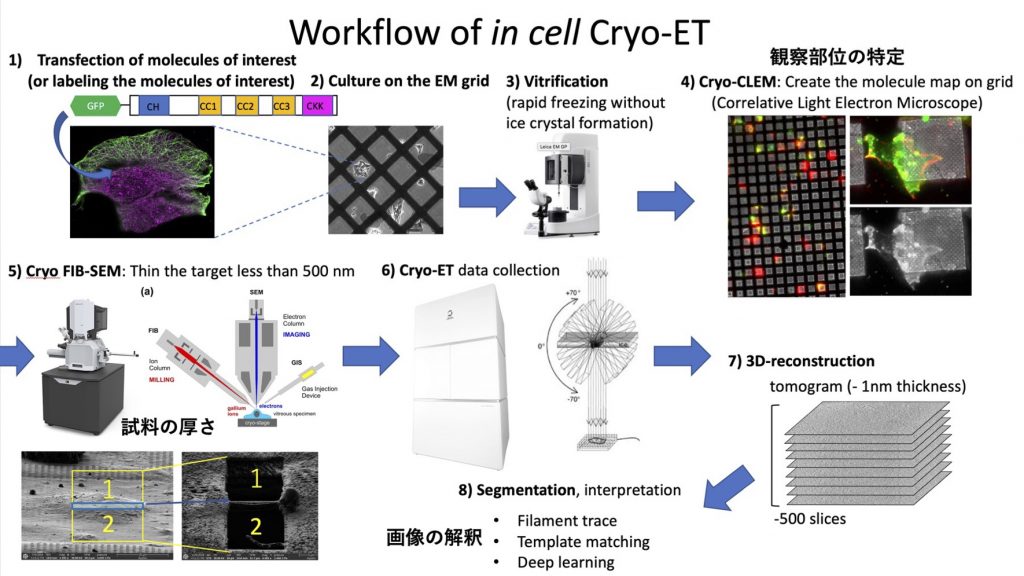
7) クライオ電子線トモグラフィー技術の整備
(学術変革領域(A)クロススケール新生物学)
クライオ電子線トモグラフィー法(Cryo-ET)は、細胞内の分子構造をサブナノメートルの分解能で可視化できる画期的な技術です。本手法のスループットを上げるとともに、時間軸・空間軸の異なる様々な手法を併用して、将来的な分子病理診断学への応用を目指します。
- クロススケール構造解析手法の整備
- タイムラプスクライオ電子顕微鏡法の整備
査読あり論文
- Structural basis of membrane recognition of Toxoplasma gondii vacuole by Irgb6.
Yumiko Saijo-Hamano, Aalaa Alrahman Sherif, Ariel Pradipta, Miwa Sasai, Naoki Sakai, Yoshiaki Sakihama, Masahiro Yamamoto, Daron M Standley, Ryo Nitta
Life Sci Alliance. e202101149. 2021年11月 - A practical method for efficient and optimal production of Seleno‐methionine‐labeled recombinant protein complexes in the insect cells
Sabine Wenzel*, Tsuyoshi Imasaki*, Yuichiro Takagi
Protein Science 28(4) 808-822 2019年4月 *筆頭著者 - Bmi1 counteracts hematopoietic stem cell aging by repressing target genes and enforcing the stem cell gene signature
Eriko Nitta, Naoki Itokawa, Shogo Yabata, Shuhei Koide, Li-Bo Hou, Motohiko Oshima , Kazumasa Aoyama, Atsunori Saraya, Atsushi Iwama
Biochem Biophys Res Commun 521(3):612-619. 2019年11月 - Bmi1 restricts the adipogenic differentiation of bone marrow stromal cells to maintain the integrity of the hematopoietic stem cell niche
Yuko Kato, Li-Bo Hou, Satoru Miyagi, Eriko Nitta, Kazumasa Aoyama, Daisuke Shinoda, Satoshi Yamazaki, Wakako Kuribayashi, Yusuke Isshiki, Shuhei Koide , Sha Si, Atsunori Saraya, Yumi Matsuzaki, Maarten van Lohuizen, Atsushi Iwama
Exp Hematol. 76:24-37 2019年 - High-resolution crystal structure of human asparagine synthetase enables analysis of inhibitor binding and selectivity.
Wen Zhu, Ashish Radadiya, Claudine Bisson, Sabine Wenzel, Brian E Nordin, Francisco Martínez-Márquez, Tsuyoshi Imasaki, Svetlana E Sedelnikova, Adriana Coricello, Patrick Baumann, Alexandria H Berry, Tyzoon K Nomanbhoy, John W Kozarich, Yi Jin, David W Rice, Yuichiro Takagi, Nigel G J Richards
Communications biology 2 345-345 2019年 - Structural insight into microtubule stabilization and kinesin inhibition by Tau family MAPs.
Hideki Shigematsu*, Tsuyoshi Imasaki*, Chihiro Doki, Takuya Sumi, Mari Aoki, Tomomi Uchikubo-Kamo, Ayako Sakamoto, Kiyotaka Tokuraku, Mikako Shirouzu, Ryo Nitta
Journal of Cell Biology 217(12) 4155-4163 2018年12月 *筆頭著者 - Kinesin-binding-triggered conformation switching of microtubules contributes to polarized transport.
Tomohiro Shima, Manatsu Morikawa, Junichi Kaneshiro , Taketoshi Kambara, Shinji Kamimura, Toshiki Yagi Hiroyuki Iwamoto, Sotaro Uemura, Hideki Shigematsu, Mikako Shirouzu, Taro Ichimura, Tomonobu M Watanabe, Ryo Nitta, Yasushi Okada , Nobutaka Hirokawa
Journal of Cell Biology 217(12):4164-4183 2018年12月 - Recent progress in structural biology: lessons from our research history.
Ryo Nitta, Tsuyoshi Imasaki, Eriko Nitta
Microscopy (Oxford, England) 2018年5月 - Titer estimation for quality control (TEQC) method: A practical approach for optimal production of protein complexes using the baculovirus expression vector system
Tsuyoshi Imasaki, Sabine Wenzel, Kentaro Yamada, Megan L. Bryant, Yuichiro Takagi
PLoS ONE 13(4) e0195356 2018年4月 - Structural insights into the altering function of CRMP2 by phosphorylation
Takuya Sumi, Tsuyoshi Imasaki, Mari Aoki, Naoki Sakai, Eriko Nitta, Mikako Shirouzu, Ryo Nitta
Cell Structure and Function 43(1) 15-23 2018年2月 - Structural basis for CRMP2-induced axonal microtubule formation
Shinsuke Niwa, Fumio Nakamura , Yuri Tomabechi, Mari Aoki, Hideki Shigematsu , Takashi Matsumoto, Atsushi Yamagata, Shuya Fukai , Nobutaka Hirokawa, Yoshio Goshima, Mikako Shirouzu, Ryo Nitta
Scientific Report 6;7(1):10681. 2017年9月
Preprint (bioRxiv)
- Structural model of microtubule dynamics inhibition by Kinesin-4 from the crystal structure of KLP-12 – tubulin complex
Shinya Taguchi*, Juri Nakano*, Tsuyoshi Imasaki,* Tomoki Kita, Yumiko Saijo-Hamano, Naoki Sakai, Hideki Shigematsu, Hiromichi Okuma, Takahiro Shimizu, Eriko Nitta, Satoshi Kikkawa, Satoshi Mizobuchi, Shinsuke Niwa, Ryo Nitta *筆頭著者
bioRxiv 2022年2月15日 - CAMSAP2 organizes a γ-tubulin-independent microtubule nucleation centre
Tsuyoshi Imasaki*, Satoshi Kikkawa*, Shinsuke Niwa, Yumiko Saijo-Hamano, Hideki Shigematsu, Kazuhiro Aoyama, Kaoru Mitsuoka, Mari Aoki, Ayako Sakamoto, Yuri Tomabechi, Naoki Sakai, Mikako Shirouzu, Shinya Taguchi, Yosuke Yamagishi, Tomiyoshi Setsu, Yoshiaki Sakihama, Takahiro Shimizu, Eriko Nitta, Masatoshi Takeichi, and Ryo Nitta *筆頭著者
bioRxiv 2021年3月1日
研究に関する日本語の総説
- 吉川 知志, 仁田 英里子, 今崎 剛, 仁田 亮. 微小管結合タンパク質. 生体の科学 (2020年8月15日発行) [特集]細胞機能の構造生物学. Vol.71 No.4 (pp. 298-303) 公益財団法人金原一郎記念医学医療振興財団/医学書院 ISSN 0370-9531
- 仁田 亮, 今崎 剛. 実験医学 (2020年3月増刊号) 田中 啓二, 若槻 壮市 編 イメージング時代の構造生命科学. 細胞骨格が制御する細胞内の営みをトランススケールに理解する. 羊土社 Vol. 38, No.5.
- 今崎 剛, 仁田 英里子, 仁田 亮.分子構造解析で何が見えるか. 小室 一成 編.新しい臨床を開拓するための分子循環器病学 1版 Cutting Edge of Molecular Cardiology. 2019.南山堂.
- 仁田 亮. キネシンスーパーファミリータンパク質の多様な機能を支える分子構造基盤. 顕微鏡 (解説), 53巻2号
- 仁田 亮. 実験医学 (2018年5月号) クライオ電子顕微鏡による構造解析が拓く次世代の生命科学・創薬.X線とクライオ電顕で微小管モーターの動きに迫る. 羊土社 Vol.36 No.8,PP.1323-1327.
- 廣川 信隆, 仁田 亮. 生体分子モーター. 入門 構造生物学, 加藤 龍一 編, 共立出版, 146-55, 2010. ISBN 978-4-320-05704-3.
主な研究手法
- クライオ電子顕微鏡構造解析:単粒子解析、クライオ電子線トモグラフィー
- X線結晶構造解析
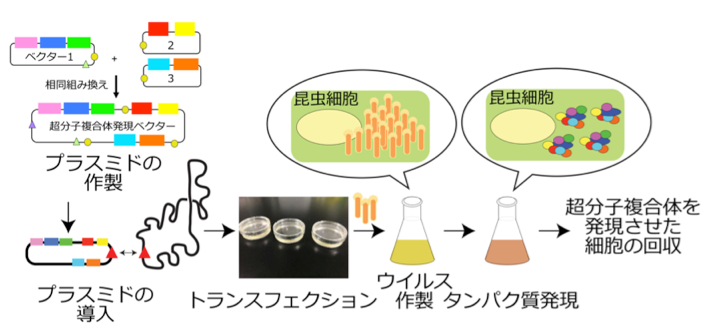
- 超分子複合体の組換えタンパク質調整
- フローサイトメトリー (FCM) / 蛍光活性化セルソーティング (FACS)
- 次世代シークエンス解析

(我々の構造が表紙に使われています)

(我々の構造が表紙に使われています)
主な研究設備や利用している共用施設
- 透過型電子顕微鏡:日本電子JEM 1400-Plus
- クライオトランスファーホルダー:Gatan 626
- 真空蒸着装置:日本電子IB029510VET
- 急速凍結装置:Leica EM GP2, Thermo Fisher Vitrobot MARK IV
- 光電子相関顕微鏡:Leica Cryo-CLEM
- 液体クロマトグラフィーFPLC:Cytiva Acta pure, BioRad NGC Quest 10 Plus
- 全反射照明蛍光顕微鏡:NIKON Ti2-LAPPシステム全反射エバネッセント顕微鏡



