Preprint journals
- CAMSAP2 organizes a γ-tubulin-independent microtubule nucleation centre.
Selected Publications
研究内容の詳細は以下のプレスリリースをご覧ください ↓↓
Shigematsu H, Imasaki T, Doki C, Sumi T, Aoki M, Kamo TU, Sakamoto A, Tokuraku K, Shirouzu M, Nitta R.
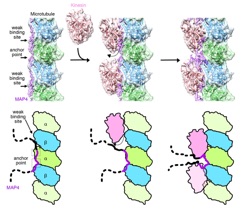
Structural insight into microtubule stabilization and kinesin inhibition by Tau-family MAPs. J. Cell Biol. doi: 10.1083/jcb.201711182
研究内容の詳細は以下のプレスリリースをご覧ください ↓↓
Niwa S, Nakamura F, Tomabechi Y, Aoki M, Shigematsu H, Matsumoto T, Yamagata A, Fukai S, Hirokawa N, Goshima Y, Shirouzu M, Nitta R.
Structural basis for CRMP2-induced axonal microtubule formation. Sci. Rep. 7: 10681. doi:10.1038/s41598-017-11031-4, 2017.
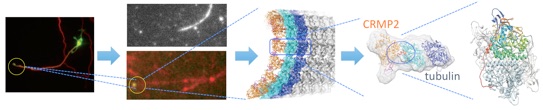
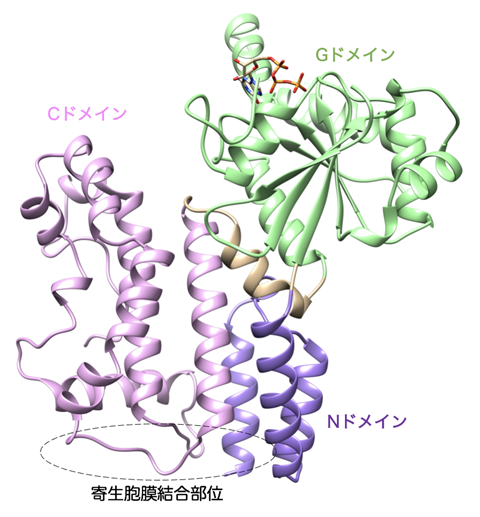
/構造生物学的手法と細胞生物学的手法を融合し、原子から個体レベルまでスケールが異なる階層で同一の分子の構造・機能を追う「シームレス構造生物学」を実践した報告である。題材は微小管結合蛋白質CRMP2で、CRMP2の微小管ダイナミクス制御を通じた軸索伸長制御作用に着目し、CRMP2が軸索型微小管の重合を促す事により効率良く軸索を伸ばすことを解明した。
Wang D, Nitta R, Morikawa M, Yajima H, Inoue S, Shigematsu H, Kikkawa M, Hirokawa N.
Motility and Microtubule Depolymerization Mechanisms of the Kinesin-8 motor, KIF19A. ELife 2016 pii: e18101. doi: 10.7554/eLife.18101.
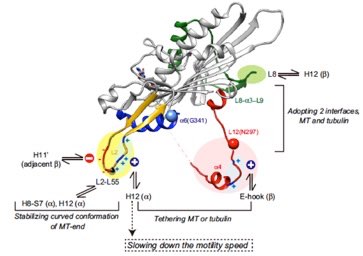
/キネシン型モーターKIF19Aは微小管上を一方向性に動き、端まで到達すると微小管を脱重合する二刀流キネシンである。KIF19Aは線毛の長さを適切に保ち、その異常は不妊や脳室拡大、易感染性などを呈する。本論文では、KIF19Aが2つの異なる機能を達成するための構造基盤を解明した。KIF19Aの微小管結合部位にサスペンションに似たあそびを作ることで、微小管のどの部分にも結合できるように調整されていた。
Yamagishi M, Shigematsu H, Yokoyama T, Kikkawa M, Sugawa M, Aoki M, Shirouzu M, Yajima J, Nitta R.
Structural basis of backwards motion in kinesin-1–kinesin-14 chimera: implication for kinesin-14 motility. Structure 2016 24;1322-34.
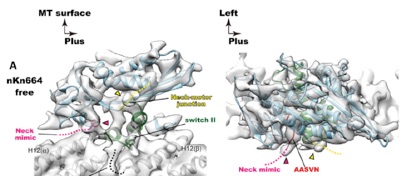
/kinesin-14は、他のキネシンと類似した立体構造を持ちながら、微小管を逆向きに動く特異なモーターであり、染色体分裂を牽引する。本論文では、逆向きに動くために不可欠な5アミノ酸残基を特定し、その役割をクライオ電子顕微鏡により構造生物学的に明らかにした。この5残基は、キネシン共通の構造変化を、kinesin-14特有のバックギアのスイングへと変換するコンバーターの役割を果たしていた。
Morikawa M, Yajima H, Nitta R, Inoue S, Ogura T, Sato C, Hirokawa N.
X-ray and Cryo-EM Structures Reveal Mutual Conformational Changes of Kinesin and GTP-Microtubule upon binding. EMBO J. 2015 34:1270-86.
/キネシン型モーターKIF5は、神経細胞軸索突起に特有の形態を持つ微小管を道標として、多数の樹上突起の中から軸索突起のみに進入する。本論文では、クライオ電子顕微鏡解析によりKIF5と軸索型微小管の複合体の構造を明らかにし、KIF5の道標の構造基盤を解明した。また、KIF5の結合が微小管の構造変化を誘起し、KIF5が結合しやすい形態へ変わることも示した。
Yamashita M, Nitta E* and Suda T.*
Aspp1 preserves hematopoietic stem cell pool integrity and prevents malignant transformation. Cell Stem Cell. 17(1), pp23-34. 2015.
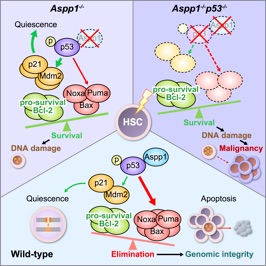
/造血幹細胞は細胞周期の静止期にあり、遺伝子変異から守られる一方で、修復が困難で変異を蓄積しやすいというジレンマを抱えている。本論文ではがん抑制遺伝子p53とアポトーシス関連因子Aspp1が協調して損傷を負った細胞にアポトーシスを誘導して造血幹細胞プールの健全性を維持していることを示し、造血幹細胞が自ら腫瘍を抑制する機構を持つことを証明した。
Chang Q, Nitta R, Inoue S, Hirokawa N.
Structural Basis for the ATP-induced Isomerization of Kinesin. J. Mol. Biol. 2013 425:1869-80.
/キネシン型分子モーターKIF4は、染色体の紡錘糸微小管のダイナミクスを止めて微小管を安定化するという特異な働きを持つ分子である。本論文ではその結晶構造を初めて報告し、変異体の解析も並行して行うことで、微小管のダイナミクスに重要なアミノ酸を特定した。その阻害剤は、染色体分裂を制御する可能性があり、抗がん剤などの創薬への応用も視野に入る。
Yajima H., Ogura T, Nitta R, Okada Y, Sato C, Hirokawa N.
Conformational Changes in Tubulin in GMPCPP and GDP-taxol Microtubules Observed by Cryo Electron Microscopy. J. Cell Biol. 2012 198:315-22.
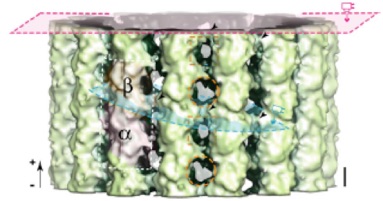
/本論文では、重合期微小管のクライオ電子顕微鏡構造を世界で初めて明らかにし、微小管が重合・脱重合を繰り返す性質(動的不安定性)の構造基盤を解明した。微小管の構成分子チュブリンの、キネシンにも似た大きな構造変化を捉えた。動的不安定性は、細胞の極性形成や細胞分裂など、生命の根幹に関わる現象を牽引している性質であり、神経細胞成熟過程の分子機構解明など重要な生命現象理解への足がかりとなる成果である。
Hirokawa N, Nitta R, Okada Y.
The mechanisms of kinesin motor motility: lessons from the monomeric motor KIF1A. Nat. Rev. Mol. Cell Biol. 2009 10:877-84.
/キネシン型分子モーター全般に通じる動作機構について独自のモデルを提唱した。キネシンは、ATPポケットで起こる小さな構造変化を微小管結合部位の大きな構造変化へと増幅し、(1)微小管に沿った一次元ブラウン運動、(2)前方に移動しながら微小管へ結合する、(3)微小管から能動的に解離する、の3状態を遷移する。(2)の過程において確率的に前進する(ブラウンーラチェット機構)。
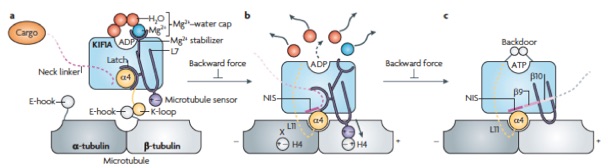
Nitta R, Okada Y, Hirokawa N.
Structural model for strain-dependent microtubule activation of Mg-ADP release from kinesin. Nat. Struct. Mol. Biol. 2008 15:1067-75.
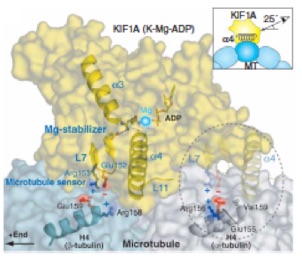
/2004年にScience誌に発表した論文の続報でキネシン型分子モーターKIF1AのADP放出過程の構造変化を、X線結晶解析を用いて捉えた。これにより、キネシンの加水分解サイクルの構造変化の全貌を世界で初めて明らかにした。前作ではキネシンの微小管脱着の分子機構を、本論文では運動方向性決定の構造基盤を明らかにした。つまりキネシンは、ADP放出過程で前後方向に非対称な微小管結合面を作り、確率的に前へ結合しやすくすることで前進している。
Ogawa T, Nitta R, Okada Y, Hirokawa N.
A Common Mechanism for Microtubule Destabilizers- M Type Kinesins Stabilize Curling of the Protofilament Using the Class-Specific Neck and Loops. Cell 2004 116:591-602.
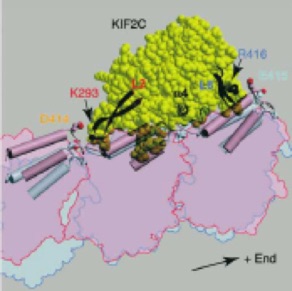
/微小管を壊す(脱重合する)ことに特化したキネシン型分子モーターKIF2Cは、細胞分裂を牽引する重要な分子である。本論文では、世界で初めてKIF2Cの結晶構造を解明し、KIF2Cの微小管脱重合機構の構造基盤を明らかにした。これによると、KIF2Cは微小管壁よりも両端に結合しやすい特性を有し、KIF2Cの微小管両端への結合が、微小管を脱重合しやすい形態へと構造変化させていることが明らかになった。
Nitta R, Kikkawa M, Okada Y, Hirokawa N.
KIF1A alternately uses two loops to bind microtubules. Science 2004 305:678-83.
/キネシン型分子モーターがATPを加水分解する際の構造変化を、X線結晶解析を用いて世界で初めて捉えることに成功した。これによるとキネシンは、共通の祖先を持つとされる低分子量GTPアーゼと非常に類似したエネルギー変換機構を用いていることがわかった。つまりキネシンの動作の本質は、ATPの加水分解エネルギーを利用して、エフェクター分子である微小管との結合・解離を繰り返すことであることが明らかになった。