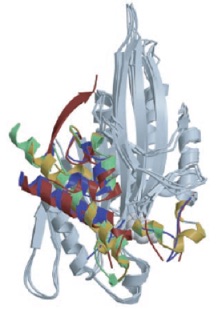
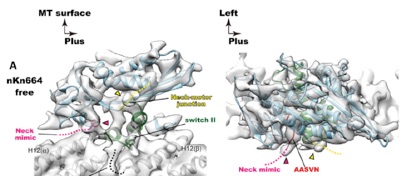
2026.01.05 学部6回生の柴田さんが筆頭著者の論文「Structural analysis of a motor with increased mechanical output reveals new transitions in kinesin microtubule motility」がScientific Reports誌に掲載されました。詳しくはこちら。
2025.12.02 特命助教としてラボに在籍していた、劉さんが筆頭著者の論文「Human spastin functions as an ATPase-independent microtubule nucleator via ring-stack formation」のプレプリントをbioRxivに公開しました。詳しくはこちら。
2025.08.09 共同研究論文「Strawberry notch 1 safeguards neuronal genome via regulation of Yeats4 expression」がCell Death Discovery誌に掲載されました。詳しくはこちら。
2025.08.05 関西医学生リトリートにおいて、博士課程3年 長田樹さんが大学院生部門のポスター賞を受賞しました。
2025.07.01 今崎剛 学内講師、仁田亮 教授の論文「最新の電子顕微鏡解析により明らかとなった心筋サルコメア構造と機能」がファルマシア誌に掲載されました。詳しくはこちら。
2025.06.10 第81回日本顕微鏡学会総会において、仁田亮 教授が瀬藤賞(学会賞)を受賞しました。
2025.05.11 国際共同研究論文「Enhanced axonal transport in large vertebrates:KIF5A adaptations in giraffes and pythons」のプレプリントをbioRxivに公開しました。詳しくはこちら。
2025.04.30 共同研究論文「Cryo-ET of actin cytoskeleton and membrane structure in lamellipodia formation using optogenetics」のプレスリリースが出ました。詳しくはこちら。
2025.04.25 共同研究論文「Cryo-ET of actin cytoskeleton and membrane structure in lamellipodia formation using optogenetics」がiScience誌に掲載されました。本誌へのリンクはこちら。
2025.04.01 共同研究論文「Dimerization of GAS2 mediates crosslinking ofmicrotubules and F-actin」がThe EMBO Journal誌に掲載されました。本誌へのリンクはこちら。
2025.03.28 学部5年生 柴田哲希さんが全国リトリート2025で演題名「クライオ電顕と分子動力学による逆行性キネシンNcd微小管上移動の分子機構解析」を発表し、ポスター賞を受賞しました。
2025.03.21 APPW2025(第130回日本解剖学会・全国学術集会)にて、博士課程2年 鈴木暖佳さんと学部5年生 柴田哲希さんがポスター発表しました。
2025.01.21 共同研究論文「Neuronal Populations Involved in Motor Function Show Prominent Expression of Sbno1 During Postnatal Brain Development」がJournal of Developmental biology誌に掲載されました。本誌へのリンクはこちら。
2024.12.02 共同研究論文「Left atrial single-cell transcriptomics reveals amphiregulin as a surrogate marker for atrial fibrillation」がCommunications biology誌に掲載されました。本誌へのリンクはこちら。
2024.10.16 第86回日本血液学会学術集会にて、博士課程2年 鈴木暖佳さんが優秀ポスター賞を受賞しました。
2024.08.22 共同研究論文「Dimerization GAS2 mediates microtubule and F-actin crosslinking」のプレプリントをbioRxivに公開しました。詳しくはこちら。
2024.08.14 共同研究論文「Cryo-electron tomography of the actin cytoskeleton and membrane organization during lamellipodia formation using optogenetics」のプレプリントをbioRxivに公開しました。詳しくはこちら。
2024.08.14 医学研究員 江村健児さんが筆頭の論文「Innervation of the human sternoclavicular joint」がClinical Anatomy誌に掲載されました。本誌へのリンクはこちら。
2024.07.30 学部5年生 柴田哲希さんが筆頭の論文「Structural transitions in kinesin minus-end directed microtubule motility」のプレプリントをbioRxivに公開しました。詳しくはこちら。
2024. 03.22 学部4年生 西川大生さんが第129回日本解剖学会総会・全国学術集会の優秀発表賞を受賞しました。
2023. 11.20 博士課程 大隈宏通さんと学術研究員として所属していた西條(濱野)由見子さんが共同筆頭著者の論文「Structural basis of Irgb6 inactivation by Toxoplasma gondii through the phosphorylation of switch I」がGenes to Cells誌に掲載されました。本誌へのリンクはこちら。
2023. 11.10 神戸大学附属病院 血液内科の片山義雄先生との共同研究論文「Amyloid deposition through endocytosis in vascular endothelial cells」がExperimental Hematology誌に掲載されました。本誌へのリンクはこちら。
2023. 8.7 生体シグナル制御学部門 的崎研究室との共同研究論文「CD47 promotes peripheral T cell survival by preventing dendritic cell–mediated T cell necroptosis」が PNAS誌に掲載されました。本誌へのリンクはこちら。プレスリリースはこちら。
2023. 4.14 博士課程 大隈宏通さんが筆頭著者と同等の貢献、仁田教授が責任著者の論文「TEAD1 trapping by the Q353R–Lamin A/C causes dilated cardiomyopathy」が Science Advances 誌に掲載されました。本誌へのリンクはこちら。
2023. 4.3 博士課程に宮地洋希くん、武田紘子さん、長田樹くん、鈴木暖佳さんが進学しました。博士課程の久野舟平くんが参加しました。メンバーページを更新したので参照ください。
2023. 3.28 来年度に博士課程進学予定の長田樹くん、鈴木暖佳さんが令和5年度 新規SPRINGプロジェクト生に採択されました。
2023. 3.23 修士1年生の松本奈央さんと学部3回生の柴田哲希くん、来年度に博士課程入学予定の長田樹くんが第128回日本解剖学会総会・全国学術集会の優秀発表賞を受賞しました。
2023. 2.20 当分野6回生の川端野乃子さんが、神戸大学医学部医学科卒業生最優秀研究賞を受賞しました。受賞の様子はこちら。
2022. 11.15 特命助教採用情報を掲載しました。=> 募集は終了しました。
2022. 11.1 博士課程 大隈宏通さんが筆頭の論文「Structural basis of Irgb6 inactivation by Toxoplasma gondii through the phosphorylation of switch I」のプレプリントをbioRxivに公開しました。詳しくはこちら。
2022. 9.9 先日publishされた論文のプレスリリースが神戸大学、東北大学、SPring-8から出ました。神戸大学 東北大学 SPring-8
2022. 9.6 博士課程 田口真也さんが筆頭の論文が eLife に掲載されました。原著論文はこちら。eLife digestはこちら。
2022. 8.1 博士課程 田口真也さん筆頭のpreprint論文がeLife誌にアクセプトされました。正式出版までお待ちください。プレプリントはこちら。
2022. 6.28 仁田研究室と共同研究グループのCAMSAP2の論文がeLifeにPublishされ、神戸大学、東北大学、JST、AMED、SPring-8からプレスリリースがでました。神戸大学 東北大学 JST AMED SPring-8 eLife digestはこちら。
2022. 4.1 特命助教として加藤尭彬さん、修士課程で鈴木暖佳さん、松本奈央さんがラボに参加しました。
2022. 3.31 修士課程、桐山大輝さんが修士課程を修了しました。学部生、宮地洋希さんと北野良多が卒業しました。宮地洋希さんは初期研究後、来年度からラボに参加予定です。
2022. 3.29 第127回日本解剖学会総会・全国学術集会 学生セッションで発表した当研究室 5回生、川端野乃子さんと6回生、宮地洋希さんが優秀賞を受賞しました。
2022. 2.16 博士課程 田口真也さんの論文のpreprintを、bioRxivに公開しました。詳しくはこちら。
2021.11.26 今崎剛 特命助教が代表の研究提案「微小管を軸とした細胞極性形成機構の解明」が、科学技術振興機構(JST)創発的研究支援事業に採択されました。(実施期間 令和3- 最長令和10年度)。
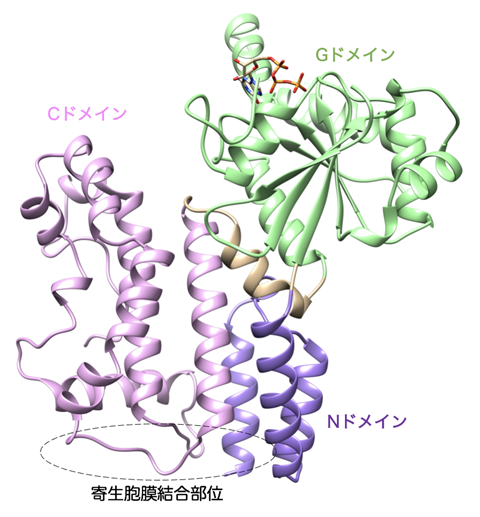
2021. 11. 9 西條由見子学術研究員の論文が、国際学術誌 Life Science Alliance にオンライン公開されました。 Structural basis of membrane recognition of Toxoplasma gondii vacuole by Irgb6. Saijo-Hamano Y. et al., Life Sci Alliance. doi:10.26508/lsa.202101149
2021. 10. 8 仁田研究室ではAMEDの「感染症創薬に向けた研究基盤の構築と新規モダリティ等の技術基盤の創出」として実施している「革新的化合物探索・合成手法による新規抗菌アジュバントの創出」における研究員,特命助教の募集を行います。詳細は学内サイトまたはJREC-INよりご参照ください。=> 募集は締め切りました。
2021. 9. 22 仁田亮教授が計画研究代表者の研究提案 学術変革領域研究(A) クロススケール新生物学 (実施期間 令和3~7年度) が採択されました。
2021. 9. 22 今崎剛特命助教が分担者の研究提案「革新的化合物探索・合成手法による新規抗菌アジュバントの創出」が、AMEDの研究領域「感染症創薬に向けた研究基盤の構築と新規モダリティ等の技術基盤の創出」のAMED-CRESTに採択されました (実施期間 令和3~8年度) 。
2021. 9. 22 仁田亮教授の研究がJSTムーンショット型研究開発事業 ムーンショット目標2 研究開発プロジェクト「臓器連関の包括的理解に基づく認知症関連疾患の克服に向けて」の課題推進者として採択されております。 (実施期間 令和2~)
Structural insight into microtubule stabilization and kinesin inhibition by Tau-family MAPs. Shigematsu H, et al., J. Cell Biol. doi: 10.1083/jcb.201711182
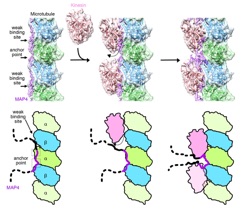
細胞の形を制御する微小管結合タンパク質の1つMAP4の詳細な構造をクライオ電子顕微鏡を用いて明らかにしました。本研究成果により、MAP4による微小管の安定化の仕組みや、微小管を介した細胞内物質輸送を阻害する作用を分子構造から理解することができました。これらの知見は、心臓肥大の病態解明や、新たな治療薬の開発につながる可能性を提示しました。
プレスリリース1 神戸大学 Research at Kobe サイト
プレスリリース2 北海道新聞サイト
プレスリリース3 室蘭民報サイト
Structural basis for CRMP2-induced axonal microtubule formation. Niwa S, et al., Sci. Rep. 7: 10681. doi:10.1038/s41598-017-11031-4, 2017.
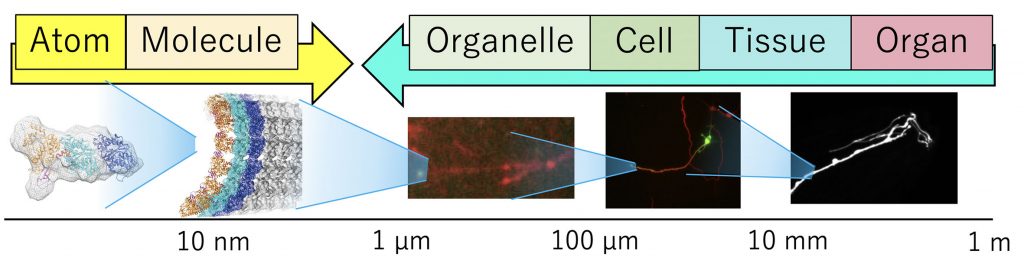
/構造生物学的手法と細胞生物学的手法を融合し、原子から個体レベルまでスケールが異なる階層で同一の分子の構造・機能を追う「シームレス構造生物学」を実践した報告である。題材は微小管結合蛋白質CRMP2で、CRMP2の微小管ダイナミクス制御を通じた軸索伸長制御作用に着目し、CRMP2が軸索型微小管の重合を促す事により効率良く軸索を伸ばすことを解明した。
Motility and Microtubule Depolymerization Mechanisms of the Kinesin-8 motor KIF19A. Wang D, Nitta R, Morikawa M, Yajima H, Inoue S, Shigematsu H, Kikkawa M, Hirokawa N. ELife 2016 pii: e18101. doi: 10.7554/eLife.18101.
キネシン型モーターKIF19Aは微小管上を一方向性に動き、端まで到達すると微小管を脱重合する二刀流キネシンです。KIF19Aは線毛の長さを適切に保ち、その異常は不妊や脳室拡大、易感染性などを呈します。本論文では、KIF19Aが2つの異なる機能を達成するための構造基盤を解明しました。KIF19Aの微小管結合部位にサスペンションに似たあそびを作ることで、微小管のどの部分にも結合できるように調整されていました。
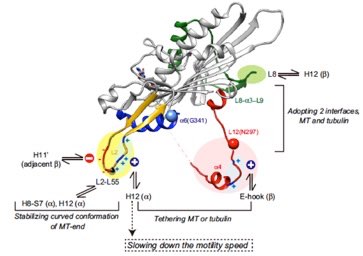
Structural basis of backwards motion in kinesin-1–kinesin-14 chimera: implication for kinesin-14 motility. Yamagishi M, et al., Structure 2016 24;1322-34.
kinesin-14は、他のキネシンと類似した立体構造を持ちながら、微小管を逆向きに動く特異なモーターであり、染色体分裂を牽引する。本論文では、逆向きに動くために不可欠な5アミノ酸残基を特定し、その役割をクライオ電子顕微鏡により構造生物学的に明らかにした。この5残基は、キネシン共通の構造変化を、kinesin-14特有のバックギアのスイングへと変換するコンバーターの役割を果たしていた。
X-ray and Cryo-EM Structures Reveal Mutual Conformational Changes of Kinesin and GTP-Microtubule upon binding. Morikawa M, et al., EMBO J. 2015 34:1270-86.
キネシン型モーターKIF5は、神経細胞軸索突起に特有の形態を持つ微小管を道標として、多数の樹上突起の中から軸索突起のみに進入する。本論文では、クライオ電子顕微鏡解析によりKIF5と軸索型微小管の複合体の構造を明らかにし、KIF5の道標の構造基盤を解明した。また、KIF5の結合が微小管の構造変化を誘起し、KIF5が結合しやすい形態へ変わることも示した。
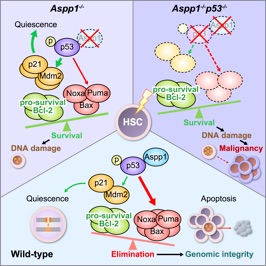
Aspp1 preserves hematopoietic stem cell pool integrity and prevents malignant transformation. Yamashita M, Nitta E* and Suda T.* Cell Stem Cell. 17(1), pp23-34. 2015.
造血幹細胞は細胞周期の静止期にあり、遺伝子変異から守られる一方で、修復が困難で変異を蓄積しやすいというジレンマを抱えている。本論文ではがん抑制遺伝子p53とアポトーシス関連因子Aspp1が協調して損傷を負った細胞にアポトーシスを誘導して造血幹細胞プールの健全性を維持していることを示し、造血幹細胞が自ら腫瘍を抑制する機構を持つことを証明した。
Structural Basis for the ATP-induced Isomerization of Kinesin. Chang Q, et al., J. Mol. Biol. 2013 425:1869-80.
キネシン型分子モーターKIF4は、染色体の紡錘糸微小管のダイナミクスを止めて微小管を安定化するという特異な働きを持つ分子である。本論文ではその結晶構造を初めて報告し、変異体の解析も並行して行うことで、微小管のダイナミクスに重要なアミノ酸を特定した。その阻害剤は、染色体分裂を制御する可能性があり、抗がん剤などの創薬への応用も視野に入る。
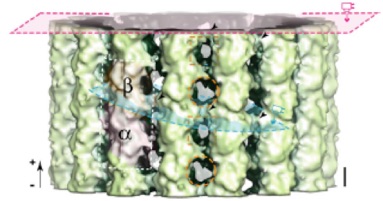
Conformational Changes in Tubulin in GMPCPP and GDP-taxol Microtubules Observed by Cryo Electron Microscopy. Yajima H., et al., J. Cell Biol. 2012 198:315-22.
本論文では、重合期微小管のクライオ電子顕微鏡構造を世界で初めて明らかにし、微小管が重合・脱重合を繰り返す性質(動的不安定性)の構造基盤を解明した。微小管の構成分子チュブリンの、キネシンにも似た大きな構造変化を捉えた。動的不安定性は、細胞の極性形成や細胞分裂など、生命の根幹に関わる現象を牽引している性質であり、神経細胞成熟過程の分子機構解明など重要な生命現象理解への足がかりとなる成果である。
The mechanisms of kinesin motor motility: lessons from the monomeric motor KIF1A. Hirokawa N, Nitta R, Okada Y. Nat. Rev. Mol. Cell Biol. 2009 10:877-84.
キネシン型分子モーター全般に通じる動作機構について独自のモデルを提唱した。キネシンは、ATPポケットで起こる小さな構造変化を微小管結合部位の大きな構造変化へと増幅し、(1)微小管に沿った一次元ブラウン運動、(2)前方に移動しながら微小管へ結合する、(3)微小管から能動的に解離する、の3状態を遷移する。(2)の過程において確率的に前進する(ブラウンーラチェット機構)。
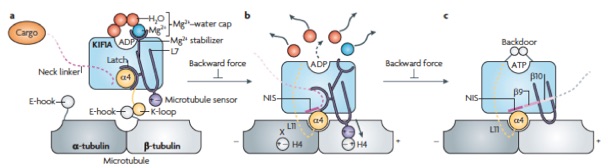
Structural model for strain-dependent microtubule activation of Mg-ADP release from kinesin. Nitta R, Okada Y, Hirokawa N. Nat. Struct. Mol. Biol. 2008 15:1067-75.
2004年にScience誌に発表した論文の続報でキネシン型分子モーターKIF1AのADP放出過程の構造変化を、X線結晶解析を用いて捉えた。これにより、キネシンの加水分解サイクルの構造変化の全貌を世界で初めて明らかにした。前作ではキネシンの微小管脱着の分子機構を、本論文では運動方向性決定の構造基盤を明らかにした。つまりキネシンは、ADP放出過程で前後方向に非対称な微小管結合面を作り、確率的に前へ結合しやすくすることで前進している。
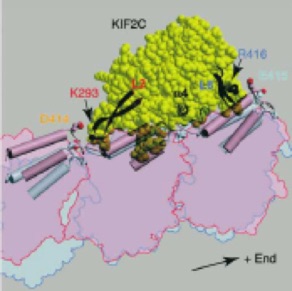
A Common Mechanism for Microtubule Destabilizers- M Type Kinesins Stabilize Curling of the Protofilament Using the Class-Specific Neck and Loops. Ogawa T, et al., Cell 2004 116:591-602.
微小管を壊す(脱重合する)ことに特化したキネシン型分子モーターKIF2Cは、細胞分裂を牽引する重要な分子である。本論文では、世界で初めてKIF2Cの結晶構造を解明し、KIF2Cの微小管脱重合機構の構造基盤を明らかにした。これによると、KIF2Cは微小管壁よりも両端に結合しやすい特性を有し、KIF2Cの微小管両端への結合が、微小管を脱重合しやすい形態へと構造変化させていることが明らかになった。
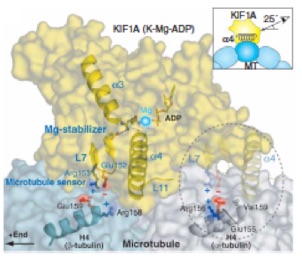
KIF1A alternately uses two loops to bind microtubules. Nitta R, et al., Science 2004 305:678-83.
キネシン型分子モーターがATPを加水分解する際の構造変化を、X線結晶解析を用いて世界で初めて捉えることに成功した。これによるとキネシンは、共通の祖先を持つとされる低分子量GTPアーゼと非常に類似したエネルギー変換機構を用いていることがわかった。つまりキネシンの動作の本質は、ATPの加水分解エネルギーを利用して、エフェクター分子である微小管との結合・解離を繰り返すことであることが明らかになった。